Termodinâmica
Leis dos Gases
1. Lei de Boyle: quando a temperatura de um gás permanece constante, isto é, não varia, o volume e a pressão mudam. Como? Se você confinar um gás em um recipiente e empurrar cada vez mais o gás, a pressão do gás irá aumentar e o volume diminuirá. Em um processo contrário, se o volume do gás expandir, a pressão diminuirá. Logo, a pressão é inversamente proporcional ao volume – quando um aumenta, o outro diminui. Esse processo é chamado de isotérmico, pois a temperatura se mantém constante.
A Lei de Boyle é apresentada como Lei de Boyle-Mariotte (Boyle, inglês, foi um; Mariotte, francês, foi outro). O que isso quer dizer? No caso, que naquela época, estudar gases estava entre o que havia de mais avançado (pesquisa de ponta...) e que vários cientistas estavam interessados no assunto. Na verdade, ninguém descobriu nada sozinho. Mariotte também fez experimentos parecidos, mas publicou-os apenas cerca de 10 anos depois de Boyle e não alegou que seus resultados fossem originais. De qualquer modo, a lei para alguns é de Boyle-Mariotte, principalmente na França.
2. Lei de Charles: relaciona o volume e a temperatura do gás, quando a pressão permanece constante. Quando a temperatura do gás aumenta, seu volume também aumenta. Isso ocorre porque, ao aumentar a temperatura, as moléculas do gás se agitam com mais frequência e se afastam umas das outras, provocando a expansão do gás. O processo à pressão constante chama-se isobárica (iso “igual” e baros “pressão”).
O interesse de Charles pelo estudo dos gases surgiu a partir da prática do balonismo, sendo um dos primeiros a atingir a temperatura de 3000 m num balão de hidrogênio.
3. Lei de Gay-Lussac: quando o volume permanece constante, a pressão e a temperatura variam. Quando a temperatura aumenta, a pressão também aumenta, pois a maior agitação das moléculas fará com que elas colidem umas com as outras e essas colisões é o que provoca a pressão exercida pelo gás. Esse processo é chamado de isovolumétrico, em que o volume é constante.




>> Quando são adicionados mais blocos em cima do êmbolo, o volume do gás diminui e a pressão aumenta, enquanto a temperatura se mantém constante. Quando alguns blocos são retirados, o gás sofre expansão aumentando o seu volume (ou seja, o gás realiza trabalho), e o êmbolo sobe. Esse processo pode ser visualizado no gráfico ao lado, com uma curva (chamada isoterma). Cada curva representa uma temperatura diferente, como na lei de Boyle a temperatura não muda, o gráfico possui apenas uma isoterma.
E aqui também >>
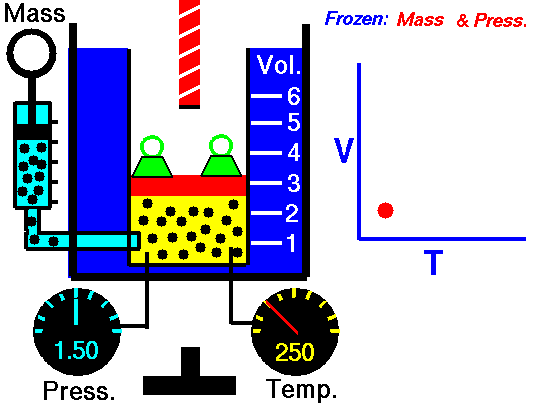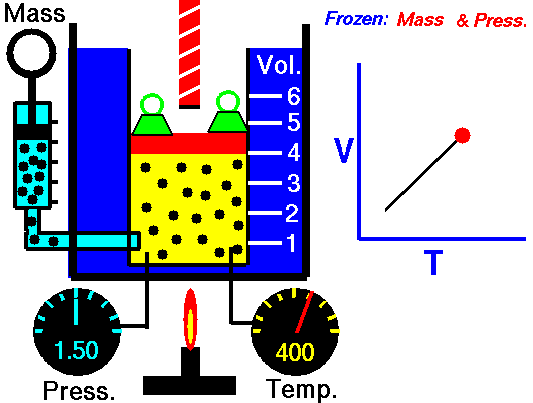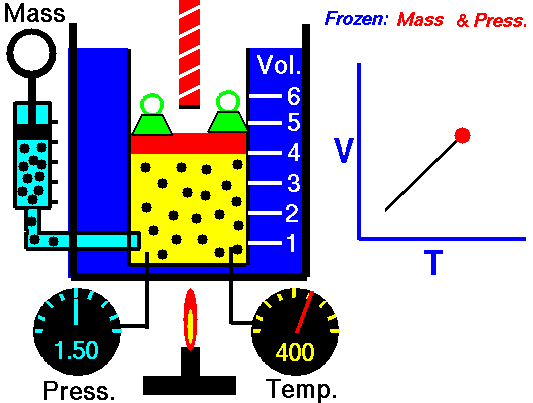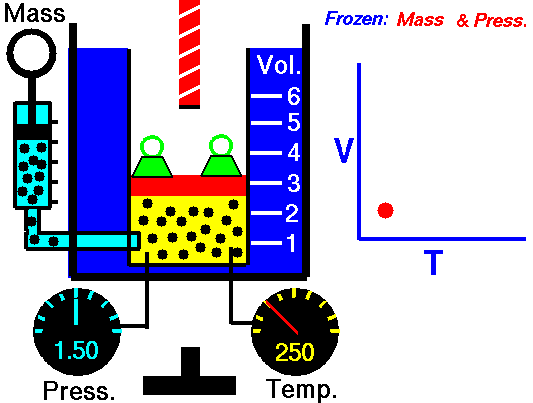
Quando a temperatura do gás aumenta, as moléculas se agitam cada vez mais e tendem a se afastar umas das outras por causa das colisões entre elas. Esse afastamento provoca uma expansão no gás, aumentando o seu volume. Então, o volume aumenta na mesma proporção que a temperatura, como mostrado no gráfico.